D131
人体での臨床試験と個人データを用いた
疫学的研究に対する倫理委員会
Ethikkommission
fuer klinische Versuche am Menschen und epidemiologische Forschung mit
personenbezogenen Daten
Tätigkeitsbericht der Ärztekammer Nordrhein 2002
ノルトライン州医師会活動報告2002:86-89頁 より
|
訳者解説 ドイツのノルトライン州医師会は約1千万人の住民を擁するドイツで2番目に大きい州医師会で、情報提供に積極的である。2002年に126頁に及ぶ「活動報告2002」を作成して無償配布したが、その後2003年と2004年には同様の活動報告を医師会のホームページで公開している。毎年ほぼ同じ目次編成になっているが、それぞれの項目の内容は更新されている。 そこには、わたしたちの目に触れることの少ない医師会活動の実際が広範囲に紹介されている。 今回は2002年版の中から、倫理委員会が担当する活動報告のうち表記のテーマを扱った箇所を翻訳した。 ドイツの州医師会は医療職法という法律により医師の監督が義務づけられているので、任意加入のわが国の医師会と直接比較することはできないが、ドイツでどのようなことが行われているかを知る上では大変参考になるのではないかと思う。 2004年7月16日 岡嶋道夫(訳) 訂正:「業務報告」を「活動報告」に訂正しました。 |
EU-指令による手続の変更
人体用医薬品を用いた臨床試験の実施のさいに、良質の臨床実務を適用することに関して、加盟国の法律及び行政規則を調整するための2001年4月4日付欧州議会と理事会のEU‐指令2001/20/EGは、2001年5月1日をもって発効した。この指令は2年間の期限内にドイツの法律に変換される。
この指令は欧州共同体設立条約、とくにその95条に基づくものである。これは倫理委員会に対する数多くの規定を含んでいる。この指令は薬事法及び必要があれば法規命令によって国の法律に変換される。
倫理委員会の手続は著しく変更される。指令には臨床試験に対する承認手続が規定されている。個々の件に対して倫理委員会の賛成意見が表明されていなければならない。これは強制的であり、従来の薬事法を著しく変更するものである。さらに研究は所轄官庁によって審査されなければならない。倫理委員会と官庁の両者に対して、決定までの期限は60日間できわめて短い。これにより官庁と倫理委員会に著しい圧力がかることになる。
倫理委員会の任務目録は内容的に著しく拡大されるが、倫理委員会と官庁との間の境界はさらに取り払われなければならない。
倫理委員会は、将来その見解を作成するさいに、以下の点を考慮しなければならない:
▪ 臨床試験の意義とその計画;
▪
EU‐指令2001/20/EGの13条2項aで規定している予期される有用性と予期されるリスクの妥当性及び結論へ至る根拠(これは薬理学/中毒学的検査基礎資料及び試験計画を手がかりとする医学的正当性の審査に相当する);
▪
試験計画
▪
試験者とその共同研究者の同意;
▪
試験者の情報;
▪
施設の質;
▪
提供される書類情報の妥当性と完全性、並びに説明後の同意に関する手続と、第3条に特別に記された制限に該当しない状況で説明後の同意を得た人への研究であることに対する正当化(違法性阻却);
▪
臨床試験に起因する障害または死亡事例の場合の補償または賠償に対する規定;
▪
試験者とスポンサーの賠償責任を補填する保険または損害補償のあらゆる種類;
▪
試験者及び試験参加者(被験者)に対するなんらかの報酬または補償に対する金額または種類、及びスポンサーと試験部署の間で用意された各契約の該当要素;
▪
試験参加者を選択する方法。
問題点
多極的な【多数の施設で別個に行われる】試験に対して、倫理委員会はただ一つの見解を示す。誰が倫理委員会に申請を提出しなければならないかは規定されていない。どの倫理委員会が管轄すべきかについても、同様に規定されていない。指令に欠けた部分があれば、薬事法で埋めることになる。
指令は医師留保を含むことを明文化していない。新しい薬品を試験する試験者は、もはや無条件に医師でなければならないというものではない。試験者の定義は、医師、または加盟国のなかで患者の世話に必要な経験を科学的背景として有し研究業務に対して認知された職業に従事している人物となっている。定義による試験者が、もはや医師でなければならないということではなく、またスポンサーは官庁に認可申請を提出できるとはいえ、医師は試験参加者の医学的ケアと医学的決定に責任を持っている。
臨床試験の場合に全経過ならびに医学的決定が通常製薬会社によって作成される試験計画によって設定されていることを考慮に入れると、試験計画を損なうという非難がなければ、医師は試験計画を全く変更することができない。そこで国の法律に変換するさいに、指令を変換しなければならない厚生省において医師の立場を主張することが切実に必要となる。そのさいに、指令が規定しているよりも、個々の点でより大きな効果をもった規定を交付する機会がある(手続規定と期限を除く)。国の法律における“医師留保”の規定は、それによって望ましいものとなるだろう。
登録された一つの倫理委員会へ依頼することで、放射線防護のためにのユーラトムEuratom−指針によって研究に対する規定が詳細に定められたことも言及する価値がある。この領域に対しても、多極的研究計画において一つの倫理委員会の決議があれば十分である。
医用器材(Medical devices)
医用器材の領域では、いくつかの研究でリスク−有用性−検討が問題となっていることが明らかとなった;とくにリスクの予見可能性。埋め込まれた医用器材の場合、患者への危害の可能性がしばしば遅くなってからはじめて明らかになる。試験参加者の保護のための問合せ行動の鎖は以下のように示されている:
▪
スポンサー(製造者)が試験医師(病院、その他)ならびに倫理委員会に通知する。
▪
医師(病院)が患者に直接または時によっては家庭医を通して情報を伝える。
▪
スポンサーは問合せ行動を通して管轄の官庁に通知する。
これらは全て患者の健康と安全の保護のために必要な手段である。
▪ 危害の可能性に関して早期に情報を伝えることで患者に対するより大きな障害を避けることができる。
いくつものEU−指令が国の法律に変換された医用器材法は、今では全ての医用器材の領域を統一的に規定するものである。危険防御の観点から、患者を保護すべき多数の規定が採用されている。これには、独立の登録されている倫理委員会によって規定された助言も含まれる。
|
1998年から2001年までの倫理委員会の助言: |
||||
|
|
1998 |
1999 |
2000 |
2001 |
|
申請 修正提案 |
323 192 |
369 227 |
393 293 |
345 253 |
1998、1999、2000及び2001年の研究は以下のとおり議決された(図1):
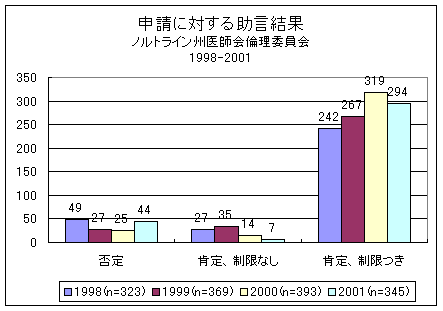 図1
図1
重大な望まない出来事(UE)に関する報告
UE:
unerwünschte Ereignisse
研究中に発生し研究参加者の安全または研究遂行に影響を及ぼした重大な望まない出来事は、薬事法(Arzneimittelgesetz, AMG)§40に従って1995年8月より倫理委員会に報告されなければならない。これらUEの把握と事前審査Vorbewertung【この意味がよく分らない】は、倫理委員会の事務局、委員長による最終的な評価と見解によってなされる。
|
重い望まない出来事についての報告数 1995-2001 |
|||
|
年 |
報告 |
事後審査* |
合計 |
|
1995 |
10 |
0 |
10 |
|
1996 |
103 |
30 |
133 |
|
1997 |
370 |
35 |
405 |
|
1998 |
1025 |
102 |
1127 |
|
1999 |
652 |
95 |
747 |
|
2000 |
669 |
259 |
928 |
|
2001 |
965 |
456 |
1421 |
|
合計 |
3794 |
977 |
4771 |
*Nachbewertung【この意味もよく分らない】
表1
データバンク
法律発効後の数年間及びとくに2001年(2000年と比較して50%以上)における報告数の著しい増加は、臨床研究で発生したUEの意義を強調するものである(表1)。これはデータバンクを創った理由であって、これは個々の出来事への速やかな介入を可能にし、とくに一つの医薬品グループの類似医薬品の間におけるUEの比較、あるいは同じ疾患の場合に用いた医薬品について比較することが可能になった。この種のデータバンクは製薬会社にも自社製品に対して存在する。製造者や製品とは関連のないデータバンクとして、倫理委員会事務局の中にあり、臨床研究のさいに現われたUEが補充されたデータバンクであるが、現在ドイツではこれを模倣したものは存在しない。これはほぼ4000の報告を有し、利用するのに有意義な規模に達している。UEの把握は、将来は全ての州医師会の倫理委員会の間で調整されなければならない。この問題のための作業グループは、2000年11月25日ケルンの作業共同体医学倫理委員会の第19回年次大会で設置された。
医薬品とUE
発生し報告された望まない出来事をATC-Code(WHOによる医薬品の解剖学的−治療的−化学的分類)の主グループに分類すると、きわめて多様な分布となる(図2)。しかしこれは、研究のスポンサーによるきわめて多様な情報、また重く発現した多様な患者の基礎疾患、及び治験の医薬品の多様なリスクに由来するものである。治験薬が研究参加者の安全、または研究の実施を損ねるかどうかは、いろいろに評価される。それだけでなく、全ての製造者が、新しい医薬品と関連する世界規模での研究で現われた全てのUEを報告するというわけではなく、薬事法による報告義務だけを満たしている。現在報告されたUEと同じように、以前から現われている類似のUEについての短報やディスカッションを付した詳細な報告がなされることは希である。
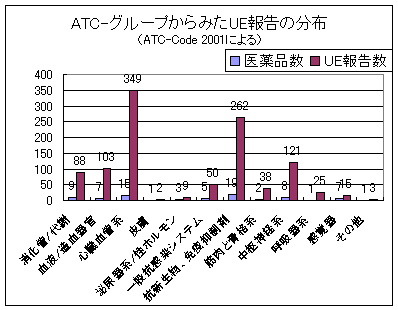
図2
臓器の種類とUE
図3は2001年(965の報告にあった2012件)に頻繁に報告された重大または予期しない出来事の分布の一覧である。これにはほとんど全ての臓器システム(WHOのterminologyに相当)に該当し、全身的な障害、消化管の障害及び精神的障害がもっとも多く現われている。希に現われた予期しない出来事(<6)はいろいろあるが、聴覚/平衡感覚障害、内分泌障害及び胎児の変化があった。
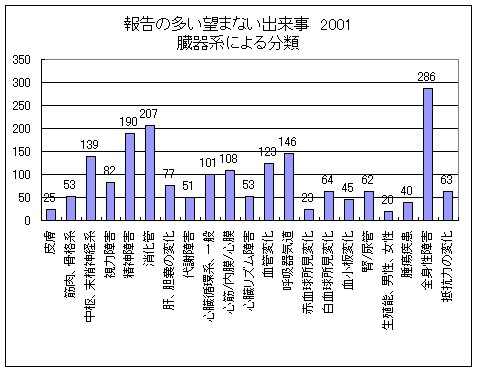
図3
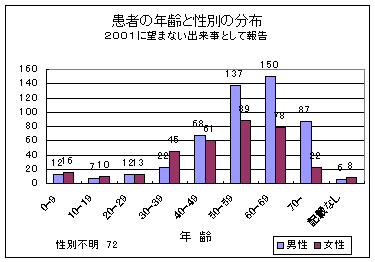
図4
UEの年齢別、性別の分布
UEが現われた患者の年齢別及び性別分布は、年齢(全報告の約2%)と性別(報告の約8%)の不呈示があったため条件付の内容となる(図4)。しかし報告の完全度からみると、望まざる作用に対する一般の把握システムよりは高くなっている。ドイツ医師協会医薬品委員会(deutsche Ärzteschaft AkdÄ)のUAW‐データバンクの報告では、例えば年齢呈示が約20%、性別呈示が約8%欠けている。【UAW: unerwünschte Arzneimittelnebenwirkung望まない薬物副作用】
約20歳までの年齢層において報告されたUEの数が少ないのは、この年齢層における研究の数が少ないこと、あるいは小児における該当する除外基準に原因がある。2001年に見られたこの年齢層の報告の増加は、小児における研究の増加傾向を反映するもので(2001年の報告では約5%、2000年の報告では約1%)、AkdÄ(2000:報告の5.4%)のデータバンクの小児における報告と比肩しうるようになった。
年齢上昇とともに報告されたUEの数が多くなることは、重大な適用(たとえばガン疾患)、合併症及びこの患者層における上昇した感受性を示すものである。AkdÄのような一般のpharmacovigilance-systemにおいては女性のUAWの報告が多い(全報告において1990-1999: 52.2%, 2000: 57%)。これとは反対に、臨床研究における女性の場合のUE報告数は少なめであるが(報告では392対501、約44%)、これは女性の研究参加者数が一般に低めになっているからである。
以上
付記
2003年の活動報告では、上記の図2と図3に相当するものが以下のような表で示されている。
|
ATC‐グループによる報告の分類 2003 |
|||
|
グループ |
項目 |
医薬品数 |
報告数 |
|
A |
消化管と代謝 |
6 |
10 |
|
B |
血液と造血臓器 |
5 |
93 |
|
C |
心臓血管系 |
13 |
219 |
|
D |
皮膚 |
1 |
1 |
|
G |
泌尿器系と性ホルモン |
8 |
64 |
|
H |
ホルモン、性ホルモンを除く |
1 |
23 |
|
J |
全身性抗感染 |
10 |
73 |
|
L |
抗新生物と免疫抑制剤 |
18 |
447 |
|
M |
筋肉と骨格系 |
2 |
24 |
|
N |
中枢神経系 |
14 |
84 |
|
R |
呼吸器系 |
7 |
151 |
|
V |
その他 |
4 |
31 |
表3
|
報告の多い望まない出来事UE、臓器系による分類 |
||
|
クラス |
項目 |
数 |
|
0100 |
皮膚と皮膚附属器 |
57 |
|
0200 |
筋肉と骨格系 |
71 |
|
0410 |
中枢及び末梢神経系 |
173 |
|
0431 |
視力障害 |
35 |
|
0500 |
精神障害 |
83 |
|
0600 |
消化管 |
232 |
|
0700 |
肝及び胆管の変化 |
57 |
|
0800 |
代謝障害 |
60 |
|
1010 |
心−循環系、全身性 |
117 |
|
1020 |
心筋、内膜、外膜、心臓弁 |
78 |
|
1030 |
心臓リズム障害 |
89 |
|
1040 |
血管の変化 |
175 |
|
1100 |
気道 |
318 |
|
1210 |
赤血球の変化 |
17 |
|
1220 |
白血球の変化 |
69 |
|
1230 |
血小板の変化 |
32 |
|
1300 |
腎と尿管 |
74 |
|
1700 |
腫瘍疾患 |
60 |
|
1810 |
全身性障害 |
323 |
|
1830 |
抵抗力の変化 |
77 |
表4